���
��� 7:���i�ɂ����闧�̉��w
�@
7.1 �J�[��-�C���S�[���h-�v�����O�iCahn-Ingolud-Prelog
= CIP)�̕��@�ɂ��D�揇�ʂ̌��ߕ��ɂ��ƁA�p���ɏ������u����̂ǂ��炪���ʂ��������������B
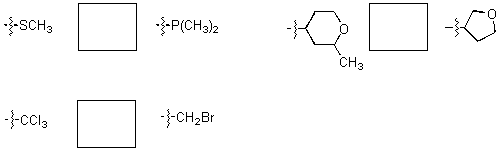
�ŏ��̖��́C�����Ɨ����Ȃ̂łǂ��炪���q�ԍ����傫�����i�����q�̍ŏ��Ɏ����\���^�����Ă���j�f����悢�B�����̕����傫���̂�
�����́@�i���j
��Ԗڂ̖��́C�ŏ��͂ǂ�����Y�f���q�Ȃ̂ŁC���̒Y�f�Ɍ������Ă��錴�q�ɒ��ڂ��Ȃ���Ȃ�Ȃ���
�ǂ�����b�C�b�C�g�@�Ȃ̂ł܂��D�揇�ʂ͌��܂�Ȃ��B
�����ŁC���̒Y�f�ɒ��ڂ����
���͂b�C�g�C�g�@�E�͂n�C�g�C�g
�Ƃ������ƂŁ@�i���j
�R�Ԗڂ́C�ǂ�����Y�f�ł������̂��ɂ��Ă���̂�
�����b���C�b���C�b��
�E�͂a���C�g�C�g
���f���L�f�̕����d���̂Ł@�i���j
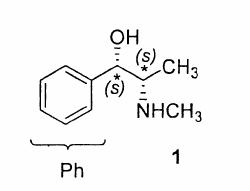
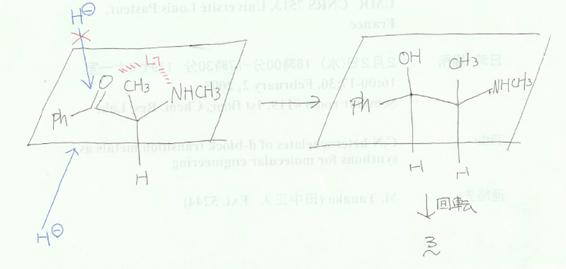
7.2 �������P�̕s�Ē��S�istereocenters�j�����Ŏ����B�i�p���̍\�����ɋL���j
�������P�̂��ꂼ��̕s�Ē��S�ɂ�����u����̗D�揇�ʂ������ق����珇�ԂɎ����A���ꂼ��̐�Δz�u�iR�܂���S)���L������B
�}�Ɏ������悤�ɁC�s�ĒY�f������邱�Ƃ͂킩��ł��傤�B
�����̕s�ĒY�f�ɒ��ڂ����
�@�n�g�@�@
�o�b�g�i�b�g�R�j�i�m�g�b�g�R�j�p���i�m�C�b�C�g�j�@�A
�@�g�@�C
�@�o�����i�b�C�b�C�b�j�@�B
�Ƃ����D�揇�ʂɂȂ�B�����ŁC���f���q�̔��Α�����`���Ɓi���}�C���̂悤�Ɂj�����i�r�́j�Ƃ킩��ł��傤�B
���l��
�b�g�R�@�B
�m�g�b�g�R�@�@
�g�@�C
�b�g�i�n�g�j�o���@�A
�ŁC�����������聁�r��
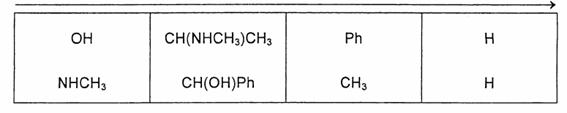
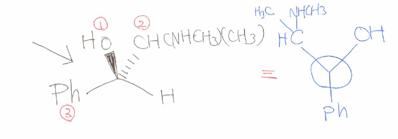
7.3 �������P�̍\�������j���[�}�����e�}�܂��͖т���isawhorse�j���e�}�̂ǂ��炩�ŕ`���B
�������P�̍\�������t�B�b�V���[���e�}�ŕ`���B
�j���[�}�����e�}�F�p���ɂo�����w�肳��Ă���̂ŁC���̕������璭�߂�Ɓi�_�������C�����т��E�ɂȂ�j
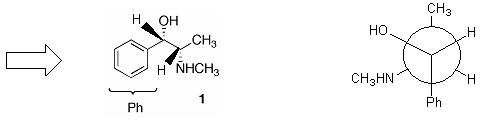
�т������{�I�ɂ͓���
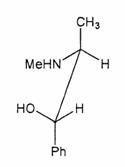
�t�B�b�V���[���e�}�F�т���Ɣ�r����ƍl���₷�����H�@���̕s�ĒY�f�͖т���Ɠ����i�������ɏo�Ă���������ʂ̎�O�ŏc���������ʉ��j�B
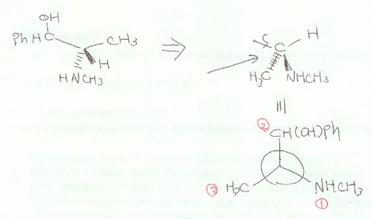
�����̕������猩��ƍl����悢�B
����C��̂ق��̕s�ĒY�f�Ń��`������ʉ��ɂ���ɂ́C�����̎����Ō��Ȃ�������Ȃ�����C�т���Ƃ͂l���m�g�C�Ƃg�̍��E���t�]����B
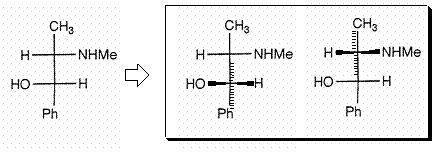
���I�ł����C�t�B�b�V���[���e�}�������璭�߂�Ɖ��̂悤�ɂȂ��Ă���Ǝv���Ƃ킩��₷���ł��傤�B�i�E�����猩���Ƃ���j
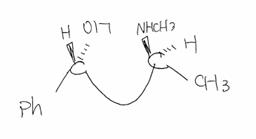
7.4 ���̉��w���܂މ������Q�̍\������`���B���̎_���Ҍ������̔������������A�����̉������̐��m�ȌW�����L������B�܂��A�������������ɂ����Ď_�������ω����錴�q�ɂ��ẮA���ꂼ��_�����������B
�A���R�[���ɂ��}���K���_���n�t��������Ǝ_������ăP�g���ɂȂ�B�i�Ƃ��Ƀx���W���A���R�[�����t�F�j����Y�f�ɂ��Ă���A���R�[�����͎_������₷���j�߃}���K���_�i�{�V�j�͊Ҍ�����ēɂȂ�̂ŁC���̂悤�ɌW�������킹�Ă����悢�B�L�@���̎_�����������Y��Ȃ��悤�ɒ��ӂ��Ȃ���Ȃ�Ȃ��B
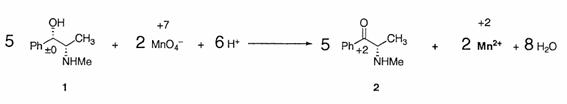
�������Q��LiAlH4 �ŊҌ�����ƍĂуA���R�[���ɂȂ�B���̗Z�_���P�Ƃ͈قȂ鉻�����R�ƌ����̂�����C�W�A�X�e���I�}�[�������Ă���̂ł͂Ȃ����Ƒz�����邱�Ƃ��ł���ł��傤�B���������ĉ��̎��̂悤�ɂȂ�B�i7.5 a�j
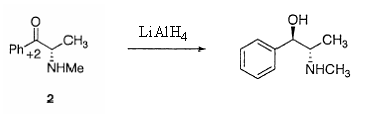
7.5���̐�����
1 �� 3 �͗��ِ̈��̂ł���
�@�A���R�[�������̗��̉��w�������قȂ�̂ŗ��ِ̈��̂ł���Ƃ�����`�ɍ����Ă���B���@������
1 �� 3 �͋����ِ��̂ł���
�@�A���R�[���̕t�����̒Y�f�͋t�����C���f�̂����Y�f�̗��̔z�u�͂܂����������ł���̂ŁC�����ِ��̂Ƃ͌����Ȃ��B�i���ɉf�����\�����������ďd�ˍ��킹�Ă݂Ă��킩��ł��傤�j���@���
1 �� 3 �̓W�A�X�e���I�}�[�ł���
�@�W�A�X�e���I�}�[�Ƃ͕����̕s�ĒY�f�����������ł��̔z�u���قȂ�ِ��́@���@�܂��ɂ��̂Ƃ���Ȃ̂ŁC������
1 �� 3 �͉�]�ِ��̂ł���
�@��]�ِ��́F���R�ɉ�]�ł���P�����ł��̃R���z���[�V�����������قȂ���̂̂��Ƃł���C�����ɂ͂܂��������Ă͂܂�Ȃ��B���@��� �@�@
7.5�b
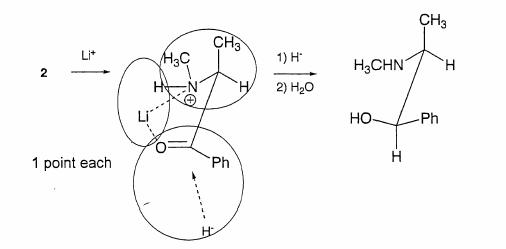
���`�E���A���~�j�E���q�h���h�iLiAlH4�j�̓C�I������ Li+ (AlH4)-
�̂悤�ɗL�@�n�}���ł͉𗣂��Ă���ƍl���܂��傤�B�����(AlH4)-��AlH3 + H- �̂悤�ɂȂ萅�f�A�j�I���iH- ���v���g���g�{����Ȃ����j���J���{�j������U�����邱�Ƃɂ��C�P�g�����A���R�[���ɂȂ�Ƃ����������������B���`�E���C�I���͋ɐ��̍����_�f���q�⒂�f���q�Ƌ����e�a��������C��̌��q���߂��ɑ��݂����肷��ƃL���[�g�i��̌��q�ł͂��܂��悤�ȏ�ԁF�}�Q�Ɓj���`�����₷���Ȃ�܂��B�L���[�g���`���ł���悤�ɂȂ�ɂ́C���̐}�̂悤�ɒY�f�|�Y�f�������s���̗ǂ���ԂɂȂ�悤�ɉ�]����B
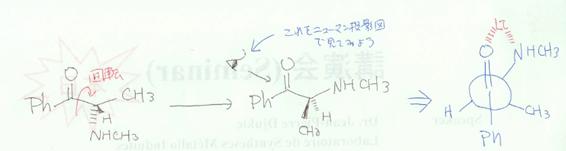
�j���[�}�����e�}�i�}�E�j�ŏ����L���[�g���Ă����Ԃ���蕪����₷���ł��傤�B
��������̐}�̂悤�ɂo����|�Y�f�|�Y�f�|�A�~�m�����̕��ʂɒu���Ă����܂��傤�B�����ŊҌ��������N����Ƃ������Ƃ͐��f�A�j�I���iH- �j���U������Ƃ������ƂɂȂ邪�C���ʂ̉�����U�����邩�C�ォ��U�����邩��̉\��������܂��B
![]()

�Ƃ��낪�C���ʂ̏ォ��U�����悤�Ƃ���Ɨׂ̒Y�f�̃��`����ז��ɂȂ�܂��B�i���̏�Q�Ƃ������Ɓj����C���ʂ̉�����U�����悤�Ƃ��Ă��C�߂��ɂ���̂͏����Ȑ��f�ŁC����قǎז��ɂ͂Ȃ�Ȃ��ł��傤�B
�}�̉E���͔�����̍\���ł����C�s�i�D�Ȃ̂ŁC���̂悤�Ɍ�������]�����Ăo���|�b�|�b�|�b�g�R�����ꕽ�ʂɗ���悤�ɂ܂킵�Ă��܂��傤�B
����ƂR�̂悤�ȗ��̔z�u�ɂȂ��Ă��邱�Ƃ��킩��ł��傤�B
���̖��̃|�C���g�́C
�@�@�L���[�g�\�����`�����Ă����Ԃ�
�A�@�R���z���[�V���������������������
�B�@���̂Ƃ���H-
���ǂ���̕�������U������Ɨ��̓I�ɋĂ��邩
�����������߂���Ă��邩�ǂ���
�Ƃ������Ƃł��傤�B
���Ȃ݂Ɏ�Î҂ɂ��͔͉͈ȉ��̂悤�Ȃ���
�@
���̏��Ղ́C���̉��w�Ɋւ����{�I�Ȗ��ł����b�I�Ȃ��Ƃ𐳂����������Ă���C����قǓ�����Ȃ��ł��傤�B
�߃}���K���_���ɂ��_��������`�E���A���~�j�E���q�h���h�iLiAlH4�j�ɂ��Ҍ������Ȃǂ́C��w�̏����I�ȗL�@���w�ł͊�{���̊�{�ł��傤�B�������C�m�����Ȃ��Ƃ���������_�����Ă�����x�Ҍ����ē������́i���͈̂Ⴄ���j���ł��Ă���悤�Ȃ��Ƃ�\�z���邱�Ƃ��\�ł��傤�B
���̑I�𐫂̐����Ȃǂ́C���Ȃ�n�C���x���ő�w�̍��w�N�ł̗L�@���w�ŏK�����x���ł��傤�B���傤�Ǒ�w�@�̓����Ȃǂɏo�邭�炢�̖��ł��傤���B
���̑O���́C�������W�Q�U�C�Q�V�������ė������Ă����Α��v�ł��傤�B�㔼���R�O�Ȃǂ𐳊m�ɗ������Ă���Ɖ�����ł��傤�B�Q�W�C�Q�X���L�@���w�̗��̑I�𐫂Ɋւ��Ċ֘A�[�����ł���C�v�Q�ƁB