解説
問題 6: ディールスアルダー(Diels-Alder)反応
本場キール大学での化学オリンピック開催となれば出題されるだろうと予想しておいてもよかったかもしれない。問題6.1から6.5は基本的な問題。endo 付加則なども理解していなければならないので,多少高度かもしれないが,それほどの難問でもない。6.6はかなり高度な有機化学の知識が必要で超難問。
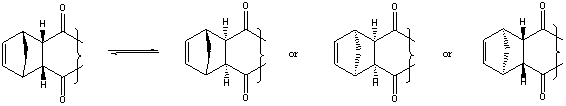
6.1 ベンゾキノンの二つの二重結合がシクロペンタジエンと反応してBができているのだから,Aはひとつだけ反応したものだろうと予想できるだろう。Bは分子式がC16H16O2だから,B−A はC5H6=シクロペンタジエン。つまり,ベンゾキノン(C6H4O2)とシクロペンタジエン(C5H6)が1:1で反応したものと考えるのが妥当でしょう。
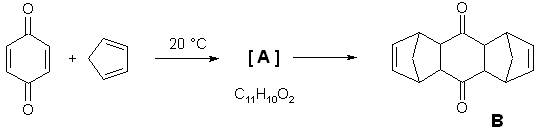
シス体のマレノニトリルとシクロペンタジエンの反応を例にあげ,ディールスアルダー反応がエンド付加で進行することを示している。このことを,ここで理解しておくことが,後ろの方の問題を解答する際に重要だろう。また,この反応の生成物はメソ体になり光学活性ではない。

6.2 前出のシス体アルケンとの反応ではメソ体が得られるが,トランス体ではラセミ体が1:1で生成することになる。したがって,D1とD2は鏡像異性体を二つ書けばよい。(トランス体の場合にはエンド付加則は考える必要が無い)
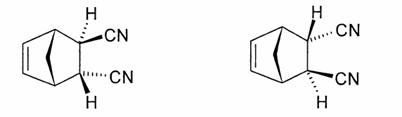
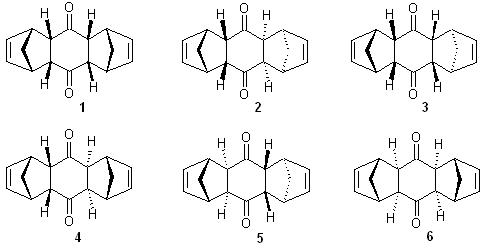
6.3 ベンゾキノンと2分子のシクロペンタジエンが反応するときの可能性をまとめてみよう。
付加の形式
A シクロペンタジエンがエンド付加するか(前述のCができる反応)エキソ付加するか(×の生成物)。
B そのシクロペンタジエンが右と左で同じ方向から来るか,別の方向から来るか。
|
|
|
A エンド付加 |
|
|
|
B エキソ付加 |
二つの反応の起こる位置
C ベンゾキノンの右も左も同じ方向から起こる。
(シスと呼ぶことにしよう)
D 右と左の起こる方向が違う(トランスと呼ぼう)
|
|
|
C シス |
|
|
|
D トランス |
下の図の1から6は上に示したパターンのどういう組み合わせか?
1 どちらもエンド付加でシス
2 どちらもエンド付加でトランス
3 左がエンド付加,右がエキソ付加でシス
4 左がエンド付加,右がエキソ付加でトランス
5 どちらもエキソ付加でトランス
6 どちらもエキソ付加でシス
ディールスアルダー反応ではエンド付加体が優先的に得られること,トランス(ベンゾキノンの二重結合に近づく方向がそれぞれ逆から)の方向から来る方が立体的に障害が少ないだろうということを考えると,2がもっともできやすいだろう。
![]()
10% 20%
70%
![]()
60% 40%
6.4 上の反応式のうち熱反応を起こすと,ディールスアルダー反応と逆反応を繰り返すだろうと考える。
また,Bに塩基を作用させると,カルボニルの隣の炭素原子上にある水素が引き抜かれて立体反転するだろう。(下のような反応式)
|
|
|||
|
|
エキソ付加 |
エンド付加 |
エキソ付加 |
|
|
向きおなじ |
向き逆 |
向き同じ |
ということを踏まえて,以下の質問の正誤を判定する。
ディールスアルダー反応は可逆反応である。
正しい:逆ディールスアルダー反応も知られている。先に熱反応で異性化が起こるということは逆反応が起こっていることに他ならない。
もとの反応でBが生成する反応は熱力学支配の反応である。
誤り:Bが熱異性化して別の化合物E,Fが生成すると言っているのだから,Bは速度論支配の生成物だろう。
BはEよりも熱力学的に安定な化合物である
誤り:Bが10%できるのに対して,Eは20%生成しているのでEの方が熱力学的にはより安定であると考えてよいだろう。
EはFよりも熱力学的に不安定である。
正しい:Eが20%に対してFが70%生成しているので,Eの方がより安定である。
G はB の鏡像異性体である。
誤り:下の反応は塩基性条件での反応であることを考えると,カルボニル基のα位水素原子の引き抜きに反応だろう。また,GがEやFとも異なる化合物(融点が違うから)であるということから,二つのα位水素とも引き抜かれたのではなく,どちらか一方だけが引き抜かれたのだろう。したがって,不斉炭素一つのみが異性化したものだと考えると,エピマー(ジアステレオマー)であり,鏡像異性体ではない。
GはFよりも熱力学的に安定である。
とちらともいえない:GとFはまったく異なる反応なので,その生成比から熱力学的な安定性を比べることはできない。また,融点からも熱力学的な安定性の優劣を決めることはできないだろう。
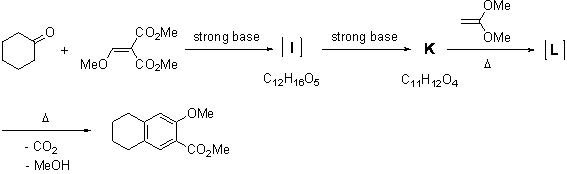
6.6 ディールスアルダー反応が利用されると問題文で言っているのだから,熱とアルケンが示されているKからLが生成する反応はディールスアルダー反応なのだろうと予想しよう。ということはKはジエンでしょう。
まず,強塩基を用いて反応させるということから,シクロヘキサノンの水素の引き抜きが起こると考える。すると,α,β不飽和カルボニル化合物への共役(マイケル)付加反応が起こるのではないかと考えることができるだろう。素直に共役付加すると下のような生成物になるが,Iの分子式に酸素が5つしかないので,脱離反応が起こっているのではないかと考えると,解答のようになる。
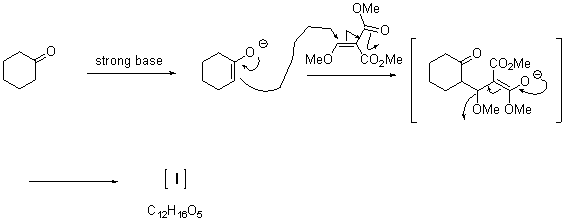
次に,強塩基を作用させることと生成物の分子式Iからさらにひとつ酸素が減っているを考慮して反応を眺めてみよう。(ちょうどCH4O減っている=CH3OH が抜けているのではないだろうか)Iに強塩基を作用させると,先の反応と同様にケトンα位の水素引き抜きが起こるだろう。(エステルのα位には水素はない)IとKの分子式を比べてみよう。メタン一分子が抜けていることがわかるでしょう。さっき,水素を引き抜いたので残るはメチル基が抜けると考えれば数があうので,二つのエステルのうちひとつが分子内反応で抜けていくのではないか,と考える。さらに,Kはジエンであることにも考慮する。
すると,シクロヘキサノンエノラート(図)の酸素原子がメチルエステルの一方と分子内反応すると都合がよい。
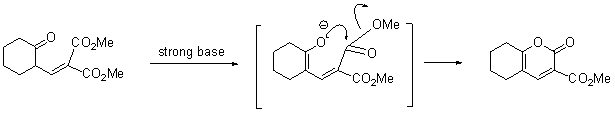
KからLの反応はディールスアルダー反応とヒントにあるので,ジエンとアルケン(式の→の上部)の反応なのだが,問題となるのは位置選択性となる。
その次の反応の生成物(ラクトンがCO2で抜けるとともにメタノールが抜けることで芳香族化する)のメトキシ基の場所を見れば,どちらの位置選択性で反応が起こっているのか予想がつくだろう。
この反応は一般的なディールスアルダー反応(電子豊富なジエンと電子不足なアルケン)と逆になっているが,熱をかければ進行しないわけではない。このときに,どの炭素原子が電子豊富で電子不足かを考えても,ディールスアルダー反応の位置選択性を説明することも可能でしょう。
準備問題集との関連
ディールスアルダー反応(22)
熱力学支配,速度論支配(24)
シクロヘキサノンの塩基による水素原子引き抜き(24)
共役付加(24)