�h�b���n�R�S�@�Q�O�O�Q�@7��
�t���j���Q����w�C�I�����_
�������W�@���{���
���_���
�|���
���c���i�i�����H�Ƒ�w�j
�ɓ����l�i�n����w�j
���K�F�i����c��w�{�������w�@�j
�����@�āi������w�j
�_���M���i�����H�Ƒ�w�j
�H����H�i������w�j
�����G�K�i���l������w�j
��c�ǕF�i���O���j�@�@
��������i������w�j
�{�Ԍh�V�i����c��w�j
��܉��F�i������w�j
�X�@�I�i�����H�Ƒ�w�j
�đ��s�i�����_�H��w�j
�W�����v�@�@���T�@�@���10�@�@���15�@�@���20
�@
���e
�@
���1�@�A�����j�A�̍���
���2�@ �_�f������~�I�O���r��
���3 �@���N�g�[�X�̉��w
���4�@�L�@�������ɂ����錴�q�̓����₷��
���5�@�O���[���P�~�X�g���[�F�d�t�@�N�^�[r
���6 �@�I��I���a
���7 �@���͎�i�Ƃ��Ă̎��O�z���X�y�N�g���@
���8 �@�������x�_
���9 �@�����ƌ����G�l���M�[
���10 �����̐���
���11 ���w���x
���12 �|�����_
���13 ���w�̃p�Y��
���14 �f���t�g�Ă��̐ƃr�^�~��B12
���15 �Ǐ������܂̍���
���16 �y�v�`�h�̍\��
���17 ���{�k�N���A�[�[
���18 �y�f�̔������x�_
���19 ����̋��啪�q
���20 �J���{��
���21 �d�C���w�I�G�l���M�[�ϊ�
���22 �~�Z��
���23 �Z���~�b�N�n�[�h�R�[�e�B���O
�@
���1�@�A�����j�A�̍���
�A�����j�A�́C�A�f�엿���̑������̉����i�Y���邽�߂ɕK�v�ȁC�d�v�Ȋ�b���w�����ł���D�A�����j�A�̍����͎��̕��t�����ɏ]���ċN����D
N2
+ 3H2 ���� 2NH3
�A�����j�A�v�����g���̐��f�̓��^���Ɛ����玟�̔����ɂ���ē�����D
CH4
+ H2O ®
CO + 3H2
���f�͋�C���瓾�邪�C��C���̎_�f��CO�Ƃ̎��̂悤�Ȕ����ɂ���ď��������D
O2
+ 2CO ®
2CO2
��C���̒��f�ܗʂ�80%�ł���D��Ɏ����������͂�������C���L�̐}�Ɏ������G�}�����풆�ōs����D�}���̖��ɁC���ꂼ��̗��H�̔ԍ����U���Ă���D
������̔����������S�ɓ]������Ɖ��肹��D�܂��C�G�̈ʒu�̃A�����j�A�̗��ʂ͎��ɂ悤�ɕ\�����̂Ƃ���Fn[NH3, �G] = 1000 mol s-1�D
1-1 �v�����g���̈ȉ��̗��ʂ�mol
s-1�̒P�ʂŌv�Z����D
n[H2, �A]�C�A�̈ʒu�ɂ����鐅�f����
n[N2, �E]�C�E�̈ʒu�ɂ����钂�f����
n[CH4, �@]�C�@�̈ʒu�ɂ����郁�^������
n[H2O, �@]�C�@�̈ʒu�ɂ����鐅����
n[CO, �B]�C�B�̈ʒu�ɂ�����CO����
n[O2, �C]�C�C�̈ʒu�ɂ�����_�f����
n[CO, �D]�C�D�̈ʒu�ɂ�����CO����
���ۂɂ́C�A�����j�A�̐����͕��t�����ł���C�������̈ꕔ�������]������ɂ����Ȃ��D�܂�C�A�����j�A�����̃��j�b�g�́C���}�Ɏ����悤�ɕ�����ƃ��T�C�N���E���j�b�g��p���ĉ^�]����Ȃ���Ȃ�Ȃ��D
�����킩��r�o����ă��T�C�N�������N2 + H2�̗��ʂ́C�����킩��r�o�����NH3��2�{�ł���Ɖ��肹��D
1-2 �F�̈ʒu�ɂ�����N2�̗��ʂƇF�̈ʒu�ɂ�����H2�̗��ʂ��v�Z����D
���x�CT = 800 K�ɂ����āC�O��̋C�̂̃M�u�X�E�G�l���M�[�͂��ꂼ�ꎟ�̂Ƃ���ł���D
G(N2) = -8.3�L103 J mol-1
G(H2) = -8.3�L103 J mol-1
G(NH3) = 24.4�L103 J mol-1
1-3 1������N2���]������Ƃ��̃M�u�X�E�G�l���M�[�ω��iDGr�j���v�Z����D
1-4 DGr�i1-3�Q�Ɓj��p���āC�A�����j�A�����̕��t�萔�CKr���v�Z����D�C�̒萔�CR = 8.314 J mol-1 K-1�Ƃ���D
���t�萔�́C�����̂悤�ɔ������̕����ŕ\�����邱�Ƃ��ł���D
�ʒu�F�ɂ�����A�����j�A�̕����͑S���ɑ��C�����̂悤�ɕ���x�ŕ\�����F
![]() �C�����ŁCx�͗��ʔ�
�C�����ŁCx�͗��ʔ�![]() �ł��\�����D
�ł��\�����D
1-5 �ʒu�F�ɂ����镪���C![]() ��
��![]() ��\������U������D
��\������U������D
1-6 ��L�ŋ��߂������̎���Kr�ɑ�����C���̌`���\�Ȍ���ȗ�������D
1-7 p0 = 0.1 Mpa�Cptot = 30 Mpa�̂Ƃ��Cx�����߂�D�i�q���g�FKr��1-4�ł��łɋ��߂Ă���j
�@
�@
���Q�@�_�f������~�I�O���r��
�~�I�O���r���i�l���j�̓w���i�S�j���������ς����̈��ł���C�_�f�����邱�Ƃ̂ł���y�f�ł���B�~�I�O���r���P���q�́C���ꂼ��_�f�P���q�Ǝ��Ɏ������̂悤�ɉt�I�Ɍ������邱�Ƃ��ł���B
Mb + O2 �� MbO2
���̂悤�Ɏ_�f�����邱�Ƃ́C�N�W���̂悤�Ȑ��������铮���ɂ͏d�v�ł���B�N�W���͂ǂ̂悤�ɂ��Ă��̋@�\���g���̂��l���Ă݂悤�B
�_�f�Ɍ��������l���͎_�f�Z�x����������ɂ�Ď��̂悤�Ȏ��������B
�@�@������ Kc �͒萔�ł���B
�_�f�͐����ɂ͂킸���ɗn���C���̗n����ʂ͎_�f�̕����ɔ�Ⴗ��B
���������āC�l���͎_�f�̕����ɑ��Ď����̂悤�ɕ\�킳���B
�@�@������ Kp �͒萔�ł���B
���̃O���t�͂��̊W���������̂ł���B�i�O���t�̖ڐ��͑ΐ��\���ł���j
�@
2-1�@��̎��ɂ�����萔 Kp �̒P�ʂƐ��l���O���t���p���Ď����Ȃ����B
�l�����q��4.5��3.5��2.5 nm �T�C�Y�̑傫���̔��Ɏ��܂���x�ł���B���q�̌`��͂قڑȉ~�`�ł���C���̔��̖��̑̐ς��߂�B����ς����̖��x�͈�ʂ�1400 kg m-3 �ł���B�A�{�K�h������ NA = 6.02 x 1023 mol-1 �ł���B
2-2�@�l���̕��q�ʂ��v�Z���Ȃ����B
�N�W���͋�C���z�����ނ��Ƃɂ��_�f��̓��Ɏ�荞�݁C���̎_�f�����𗘗p���邱�Ƃɂ�蒷���ԁC�����ɐ��邱�Ƃ��ł���B�N�W���̋ؓ��g�D��20���̓~�I�O���r������ł��Ă���Ɖ��肷��B
2-3�@�N�W���͋ؓ��g�D�P���������艽�����̎_�f�����邱�Ƃ��ł��邩�v�Z���Ȃ����B
�_�f�͎��b��R�Ă����C�G�l���M�[�i�M��^���j�邱�Ƃɗp������B���̉��w�������́C���悻�����̂悤�ɕ\�킷���Ƃ��ł���B
���̃^�C�v�̔����ɂ����o�����G�l���M�[�͎_�f1����������400 kJ �ł���B�N�W���̂悤�ȑ�^�����́C�̉���ۂ��^���������邽�߂ɂ́C�ؓ��g�D�P�����������0.5 W �̃G�l���M�[�����K�v�Ƃ���B
2-4�@�N�W���͐����ɂǂꂾ�������Ă��邱�Ƃ��\���v�Z���Ȃ����B
2-5�@���ۂ̎��b���q���R�Ă��鉻�w�������������Ȃ����B
�@
���R�@���N�g�[�X�̉��w
�I�����_�ł́A�`�[�Y�����̕��������ł�������������Ƃ��ă��N�g�[�X�i�����j�����Ȃ��K�͂ɐ��Y����Ă���B���N�g�[�X�̓x�r�[�t�[�h���i���܁j�Ɏg���Ă���B���N�g�[�X�́A�P���ł���c�|�K���N�g�[�X�Ƃc�|�O���R�[�X���琬��ł���A���̍\���i�n�[�X���e���j�����Ɏ����B�����̒P���c��c�|�K���N�g�[�X�ł���B
�R�|�P�@�c�|�K���N�g�[�X�Ƃc�|�O���R�[�X�̃t�B�b�V���[���e����`���B
���N�g�[�X���_�G�}�ʼn�����������ƁA�c�|�K���N�g�[�X�Ƃc�|�O���R�[�X��������B
�R�|�Q�@���N�g�[�X�̍\�������ɖ��Ŏ����B
�@�@�@�@�i���j�����������N�������߂ɁA�v���g������������_�f���q
�@�@�@�@�i���j���������ɂ���Đؒf�����Y�f�|�_�f����
�@�@�@�@�i���j�t�F�[�����O����Ƃ̔����i���̔����́A�Ҍ����̌��o�ɗp��
�@�@�@�@�@�@�@����j�Ɋ֗^����Y�f���q
���N�g�[�X�̉��������ɋ����G�}��p�������Y������g�ݍ��킹��ƁA�|���A���R�[���ł���\���r�g�[���ƃK���N�`�g�[����������B�����́A���ꂼ��O���V�g�[����Y���V�g�[���Ƃ��Ă��B
�R�|�R�@�\���r�g�[���ƃK���N�`�g�[���̃t�B�b�V���[���e����`���B
�@�@�@�@�܂��A�����̉����������w�����ł��邩�ۂ��������B
�H�ƃv���Z�X�ɂ����ẮA���N�g�[�X�̓��N�`�����[�X�Ɉِ�������A�����܂Ƃ��ėp������B�܂��A���N�g�[�X�𐅓Y����ƒ�J�����[�Ö����ł��郉�N�`�g�[���i�b�P�Q�̃|���I�[���j�����Y�����B�I�����_�ɂ����Ă͂ǂ���̃v���Z�X�����{����Ă���B
�R�|�S�@�i���j���N�`�����[�X���n�[�X���e���ŕ`���B
�@�@�@�@�@�@�@�i�q���g�F���N�g�[�X���̃O���R�[�X�������P�g���ł���
�@�@�@�@�@�@�@�@�@�@�@�@�t���N�g�[�X�Ɉِ�������j
�@�@�@�@�i���j���N�`�g�[�����n�[�X���e���ŕ`���B
�@
���@�S�@�L�@�������ɂ����錴�q�̓���
�L�@���w�̌����ɂ����Ĕ����̃��J�j�Y���ׂ邽�߂ɁC 2H �� 17O �Ȃǂœ��ʑ̃��x������ƗL�p�ȏ��邱�Ƃ��ł���B�ŐV�̂m�l�q�̋Z�p���g���ƁC�d���f2H��_�f�̓��ʑ�17O���ϑ����邱�Ƃ��\�ɂȂ�B
�ЂƂ̗�Ƃ��āC4�]�q�h���L�V�u�^���|2�|�I���ɓ��ʑ̂Ń��x�����邱�Ƃ��l���Ă݂悤�B
a, b, c, d �͐��f���q�Cx, y �͎_�f���q�Cm �͒Y�f���q�ł���B
4-1�@���̉�������pH=10�� 2H2O �Ɣ����������B���̂Ƃ��ɐ��f���q a �` d�@���d���f�ƌ������₷�����ԂɂȂ�ׂȂ����B
�ŏ��Ɍ���������́@���������������@�Ō�
4-2�@�����悤�� pH=10 ��H217O �Ɣ����������B�_�f���q x, y ��17O ����������₷�����ɂȂ�ׂȂ����B
�ŏ��@�������@�Ō�
4-3�@13C ���q�����̈ʒu�ɓ�������K���ȕ��@�͂���Ǝv���邩�B
yes or no
�@
���@�T�@�O���[���P�~�X�g���[�F�d�t�@�N�^�[
�@
�a�C�ɑR������ɂ݂�a�炰���肷�邽�߂̈��i����������ʂ邽�߂̍��������܂ŁC���܂��܂ȍH�ƓI���x���̗L�@�������i�����ɂ́C����Љ���藧�Ƃ͍l�����Ȃ����낤�B���ʁC�����̃v���Z�X�̑����͑�ʂ̔p���������Ă���B���̖�����������ɂ͉��w�H�Ƃ̐��Y�����炷�̂ł͂Ȃ��C�p�����̕�������菭�Ȃ�����悤�ȃN���[���ȍH�ƋZ�p�������o�����Ƃ��d�v�ł���B
���I�ɍD�܂����i�D�܂����Ȃ��j�v���Z�X���ǂ�����]������w�W�Ƃ��āC�u���q�����v��u�d�t�@�N�^�[�v�Ƃ����p�ꂪ�p������悤�ɂȂ����B���q�����Ƃ́C�ړI�Ƃ����������̕����ʂ̒l���C�����Y�����܂��Y����邷�ׂĂ̐������̂��������ʂ̘a�Ŋ��������l�ł���B�d�t�@�N�^�[�Ƃ͖ړI�Ƃ��鐶�Y���̏d�ʂP����������̕����Y���̏d�ʁi�����j�̒l�ł���B
���^�N�����_���`���͓����x�̍��������i�����q�j�̌����ƂȂ�d�v�ȃ��m�}�[�̈��ł���B���̉������Y���邽�߂́C�ȑO�ɗp�����Ă��������@�ƍŋߗp�����Ă��鍇���@��}�P�Ɏ����B
�]���@
�ŐV�@
�@
�}�P�@���^�N�����_���`���̍���
5-1�@�]���@�C�ŐV�@���ꂼ��̃v���Z�X�ɂ�����C���q�����Ƃd�t�@�N�^�[���v�Z���Ȃ����B
������̗�Ƃ��Đ}�Q�Ɏ����悤�ȃG�`�����I�L�V�h�̐���������B�]���@�ł͉����J���V�E������������B����ɁC10���̃G�`������1,,2�|�G�^���W�I�[���ɂȂ��Ă��܂��B����C�ŐV�̕��@�ł͋��G�}�ɗp����B���̕��@�́C15���̃G�`�������_���ɂ���_���Y�f�Ɛ��ɕω�����B
�ÓT�I�ȃN�����q�h�����@
�ŐV�̐Ζ����w�I��@
�}�Q�@�G�`�����I�L�V�h�̍���
5-2�@���ꂼ��̎�@�̌��q�����Ƃd�t�@�N�^�[���v�Z���Ȃ����B
�@
�@
�@
��� 6�@�@�I��I���a
�n��x�͉��̊������𑪒肷���ŏd�v�ȗv�f�ł���D�����̗n��x�Ƃ́C���ʂ̗n�}�ɂ��̕�����n���������C�O�a�n�t�ƂȂ�悤�Ȃ��̗ʂ������D�n��x�͗n���Ɨn�}�̐����ɂ��C�܂��C���x�∳�͂Ȃǂ̏����ɂ��傫���ω�����DpH����̂̐������n��x�ɉe������ł��낤�D
BaCl2�� SrCl2�����ꂼ��0.01 M�̔Z�x�Ŋ܂ސ��n�t�ɂ����āC���_�i�g���E���O�a�n�t�������邱�Ƃɂ��C�����̉������S�ɕ������邱�Ƃ͉\�ł��낤���D�����̊�́C BaSO4�Ƃ��� Ba2+�� 99.9 %�C���Ȃ킿 SrSO4���� BaSO4�� 0.1 %�ȉ��܂܂��悤�ȏ�ԂƂ���D�n��x�ς� Ksp(BaSO4) = 1�~10-10�� Ksp(SrSO4)
= 3�~10-7�ł���D
6-1 �@�@�֘A���鉻�w���������D
�@�@�@�@�c���Ba2+�̔Z�x���v�Z����D
�@�@�@�@�������ꂽ�������� Ba2+�� Sr2+�̃p�[�Z���g���v�Z����D
���̂̐������n��x�ɐ[���ւ���Ă���Ǝv���邪�C���̂Ƃ͒��S�����C�I���ɂQ�ȏ�̔z�ʎq�����������d�ׂ�L���鉻�w��ł���D�Ⴆ�� Ag(NH3)2+�͒��S������ Ag+�C�z�ʎq���Q��NH3���q�ł�����̂ł���D
AgCl�̗n��x�� 1.3�~10-5
M�D
AgCl�̗n��x�ς� 1.7�~10-10�D
��̍��̂̍��`���萔(Kf)�� 1.5�~10+7�ł���Ƃ��Ė�ɓ�����D
6-2 �@�@1.0 M�A�����j�A���n�t�ɑ��� AgCl�̗n��x�́C�����ɑ�������傫�����D�v�Z�ɂ�莦���D
���V�@���͎�i�Ƃ��Ă̎��O�z���X�y�N�g���@
���O�z���X�y�N�g���@�́A���������͎��O���̈�̂���g���ł̋z���x�̑���ɂ���ėn�t���̕����̔Z�x�����߂邽�߂ɂ悭�p������B�����o�[�g�|�x�[���̖@���͋z���x������g���ł̃����Z�x�ɔ�Ⴗ�邱�Ƃ���Ă���FA=ecl (e��Lmol-1cm-1�P�ʂ̃����z���W���A���ߒ��̒P�ʂ�cm��A = 10logl0/l)�B
�����ŁAFe(II)�t�F�i���g������(�t�F���C��?)�̎_���Ҍ��Z�x(?)�̑���ɂ�����ō��y�эŒ�Z�x�ɂ��čl���Ă݂�B
7-1�@�����x�̌덷��2%�܂Ōv�����̂Ƃ��āA1 cm�L���x�b�g���g���Ĕg��512 nm�ő���ł���t�F���C���̍Œ�Z�x���v�Z���Ȃ����B
7-2�@���ˌ��̍Œ�2%�͌��o��ɒB������̂Ƃ��āA1 cm�L���x�b�g���g���Ĕg��512 nm�ő���ł���t�F���C���̍ō��Z�x���v�Z���Ȃ����B
����M�Ɣz�ʎqL����ł�����̂̑g�����܂������w�I�ɋ��߂邱�Ƃ��ł���BJob�@�Ƃ��Ēm����A���ω��@(?)�ŁA�l�Ƃk�̃����Z�x�̘a�����ɂ��Ă��̔��ω������邱�Ƃɂ���Ă��Ƃ߂���B�������ω������邱�Ƃɂ���āA���̋z���x���̂̃�����̃O���t��������(552 nm�ő���)�B
7-3 ���̂̑g�������肵�Ȃ����A�܂��A�v�Z���������ƁB
7-4 xM = 0�ł͂ǂ̉��������z�����邩
�@�@xM = 1�ł͂ǂ̉��������z�����邩
�@�@�������ǂ̂悤�ɓ����o�����������Ȃ����B
7-5 M��L�̋z���W���̔���v�Z���Ȃ���
7-6 xM = 0�y��xM = 1�ɂ����āA�n�t���߂������ˌ��̊���(%)���v�Z���Ȃ����B
�@
���W�@�������x
�������x�̌����́A���w�����̏ڍׂɂ��ďd�v�ȏ���^���Ă����B�����ł́ANO�̐����Ƃ��̎_�f�Ƃ̔����ɂ��čl����BNO�̐����͎��̎��ɏ]���ċN����B
���x�萔k��300 K��2.6 x 10-8 Lmol-1s-1�A400K��4.9 x 10-4 L mol-1s-1
�C�̒萔��R=8.314 Jmol-1K-1
8-1 �A���j�E�X�����g����NO�̐����ɂ����銈�����G�l���M�[���v�Z���Ȃ����B
NO�Ǝ_�f�̔����͎��̂悤�ɕ\�����B
���̔����͈ȉ��̂悤�ȋ@�\�Ői�ނ��̂ƍl������B
�@�@�@
�@
8-2 ���̋@�\�Ɋ�Â���NO2�̐����ɂ����锽�����x�������߂Ȃ����B
�����I�ɂ́A�������x����s = k[NO]2[O2]�Ƌ��߂�ꂽ�B
8-3 �ǂ̂悤�Ȍ��_��������邩�B
�\�z�����@�\�͌��ł���B
�\�z�����@�\�͐������B
���̎����͏؋��ɂ͂Ȃ�Ȃ��B
�i�����������Ɉ��t���Ȃ����j
���X�@�@�����ƌ����G�l���M�[
�C�I���̍\�����C�������̔��a�ƁC�d�C�f�ʂ̐����{�ɓ���������̓d�ׂ�L����C�Ƃ����P���ȃ��f���ŕ\���C������g�����G�l���M�[�̌��ς��肩��C���⌋���̂�����鑽���̔����ߒ�����͂ł���D�Ⴆ�C�C�����ł̃C�I�������q�̉𗣂ɂ��čl���Ă݂�D�C�����ŃC�I�������q���𗣂���ƁC�X�̍\�����q�͒����̒P�ꌴ�q�̏�ԂɂȂ�D�����ŁC���̂悤�ȉ𗣂̃G�l���M�[�����߂�ɂ́C�܂��C�I���̏�Ԃʼn𗣂��i���Ƃ���NaCl�@���@Na+�@+�@Cl-�j�C���ɌX�̃C�I�������܂��͕��̓d�ׂēd�C�I�ɒ����ł��錴�q�̏�ԂƂȂ�C�Ƃ����o�H���l����悢�D���̂悤�Ȍo�H�́CBorn-Haber�T�C�N���Ƃ��Ă���D
�ȉ��Ɏ����̂́C�Q���q����Ȃ邢�����̉��w��̌����G�l���M�[�C�d�q�e�a�́C�C�I�����G�l���M�[�Ȃǂ̑���l�ł���D
NaCl�̌����G�l���M�[ = -464 kJ mol-1 Cl�̓d�q�e�a�� = -360 kJ mol-1
KC���̌����G�l���M�[ = -423 kJ mol-1 Na�̲�݉���ٷް = 496 kJ mol-1
MgCl�̌����G�l���M�[ = -406 kJ mol-1 Ca�̑�겵݉���ٷް = 592 kJ mol-1
CaCl�̌����G�l���M�[ = -429 kJ mol-1 Ca�̑��݉���ٷް =1148 kJ mol-1
9-1�@NaCl�̒������q�ւ̉𗣉ߒ���Born-Hber�T�C�N����`���CNaCl�̉𗣃G�l���M�[�����߂�D������100%�C�I���������ł���Ɖ��肵�Ă悢�D
9-2�@CaCl2�̒����R���q�ւ̉𗣉ߒ���Born-Hber�T�C�N����`���CCaCl2�̉𗣃G�l���M�[�����߂�D�R���q��̌����͂Q���q��̌������9%�Z���Ɖ��肹��D
�@�����́C���R�E�ł��C�l�H���ɂ����Ă��d�v�Ȗ����������f�ł���B���������C�j�_�C�����I�G�}�Ɏg����z�ʎq�Ȃǂ����̓T�^��ł���B�܂��C�������܂މ������̍\���ɂ��ėL�p�ȏ���^���鑪��@�Ƃ��āC31P-�j���C���i31P-NMR�j������B31P-NMR�̓����Ƃ��āC�\���I�Ɏ����������̃P�~�J���V�t�g���C���Ȃ�قȂ��Ċώ@�����Ƃ����_����������B�i�������C�v���g���Ƃ̑��ݍ�p�̓f�J�b�v�����O�ɂ���ď�����Ă�����̂Ƃ���B�j�m���F���w�ِ��́i=�G�i���`�I�}�[�j���m�̊Ԃł́CNMR�X�y�N�g���ɈႢ�͂Ȃ��B�n
�@�������_�W�A���L��A�̓��Z�~�̂̃u�^��-2-�I�[���̗U���̂ł���C�������_�W�A���L��B�͌��w�I�ɏ�����(S)-�u�^��-2-�I�[�����瓾��ꂽ���̂ł���B������A�̃v���g�����f�J�b�v������31P-NMR��}�Ɏ����B������B�̃X�y�N�g���ł͂�����̃V�O�i���݂̂��ώ@����C���̃P�~�J���V�t�g��A�̃s�[�N�̂����̈�Ɠ���ł������B�m���F�������_�W�A���L���̈�ʎ���(RO)2P-OH�ł���B�n
10-1 ������A�̃X�y�N�g���i�}1�j������ł���悤�C���ꂼ��̗��ِ̈��̂ɂ��ė��̍\����\�����ƃt�B�b�V���[���e�}�������B�܂��C������B�̗��̍\����\�����ƃt�B�b�V���[���e�}�������B
�}�P�@�`��31�o NMR �X�y�N�g���i1H �j�̓f�J�b�v�����Ă���j
������C�̓��^�m�[������U�����ꂽ�������_�W�A���L���ł���B
������D�̓v���p��-2-�I�[������U�����ꂽ�������_�W�A���L���ł���B
������E�̓��Z�~�̂�1-�t�F�j���G�^�m�[������U�����ꂽ�������_�W�A���L���ł���B
10-2 ������C, D, E��31P-NMR�X�y�N�g���ɂ͂��ꂼ�ꂢ���̃V�O�i�����ώ@����邩�B�������Q�ȏ゠��ꍇ�́C���ꂼ��̖ʐϔ䂪�����ɂȂ邩���q�ׂ�B
10-3 ������A��1H-NMR�V�O�i���̊T�`��}������B�������C�V�O�i�����m�ɏd�Ȃ�͂Ȃ����̂Ƃ���B���Ă���s�[�N�ɂ��Ă͂��ꂼ��̍����̔���������ƁB�m��Ғ��F�u�^��-2-�I�[����1H-NMR�V�O�i���̊T�`��}������C�̊ԈႢ�Ǝv����B�����Ȃ���Γ�߂��I�n
�E�B���A���E�m�[���Y�iWilliam S. Knowles�C2001�N�m�[�x����ҁj�́C�����z�ʎqF�����������W�E���G�}���p�[�L���\���a�̖�Ƃ��ďd�v��L(-)-DOPA �̍����ɗp�����B
10-4 ������F�̑S�Ă̗��ِ̈��̗̂��̍\����`���C�����̂����ǂꂪL(-)�Ȃ�����D(+) DOPA�̕s�č����ɓK���Ă��邩�������B
10-5 ������F�̃������q�̓s���~�b�h�^�i�O�p���j�̒��_�Ɉʒu���Ă���B���̂��Ƃ́C������F��
�� ���w�����Ȕz�ʎq�Ƃ��ċ@�\���邽�߂̕K�v�����ł���B
�� �ʒi�C���w�����Ȕz�ʎq�ł��邽�߂̕K�v�����ł͂Ȃ��B
�� �s���~�b�h�����]���Ȃ��ꍇ�Ɍ���C���w�����Ȕz�ʎq�ł��邽�߂̕K�v�����ƌ�����B
�� �ɂ߂č������x�ł̂݁C���w�����Ȕz�ʎq�ł��邽�߂̕K�v�����ƌ�����B
�@�@�@�i���������̂Ƀ`�F�b�N�}�[�N������B�������̂�2�ȏ゠��ꍇ�����蓾��B�j
���̌�C�����ړI�Ŕz�ʎqG���J�����ꂽ�B
10-6 �z�ʎqG�̗��ِ̈��̑S�Ăɂ��Ă��̗��̍\����`���C�����̂����ǂꂪL(-)�Ȃ�����D(+) DOPA�̕s�č����ɓK���Ă��邩�������B�i���̍\���͏�̍\�����̂悤�ɕ\�킷���Ɓj
10-7 ������G�̃������q�̓s���~�b�h�^�i�O�p���j�̒��_�Ɉʒu���Ă���B���̂��Ƃ́C������G��
�� ���w�����Ȕz�ʎq�Ƃ��ċ@�\���邽�߂̕K�v�����ł���B
�� �ʒi�C���w�����Ȕz�ʎq�ł��邽�߂̕K�v�����ł͂Ȃ��B
�� �s���~�b�h�����]���Ȃ��ꍇ�Ɍ���C���w�����Ȕz�ʎq�ł��邽�߂̕K�v�����ƌ�����B
�� �ɂ߂č������x�ł̂݁C���w�����Ȕz�ʎq�ł��邽�߂̕K�v�����ƌ�����B
�@�@�@�i���������̂Ƀ`�F�b�N�}�[�N������B�������̂�2�ȏ゠��ꍇ�����蓾��B�j
10-8 ������G��31P-NMR�X�y�N�g���ɂ͂����̃s�[�N���ώ@����邩�B�������Q�ȏ゠��Ȃ�C���ꂼ��̖ʐϔ䂪�����ɂȂ邩���q�ׂ�B
���@11�@�@�@���w���x
������w�����������̃G�i���`�I�}�[�͂��ꂼ��قȂ鐶���w�I�Ȑ����������B���Ƃ��C�A�X�p���M���_�̂q�̂͊Â����C�r�̂͋ꂢ�B���݂ł͈��i��n��ۂɂ́C���̊��������̌��w���x�ɂ͏\���Ȓ��ӂ������Ă���B�t�F�j���A���j���͂��܂��܂Ȉ��i�̌��ޗ��Ƃ��ėp������A�~�m�_�̈��ł���B�����̃G�i���`�I�}�[�����ꂼ��m�l�q���͂��Ă��C���̃V�O�i���ɈႢ�͌����Ȃ��B�������C�t�F�j���A���j��������U���̂ɕϊ�����ƁC�قȂ�m�l�q�̃V�O�i�����o�����邱�Ƃ�����B
���̂悤�ȖړI�̂��߂ɁC�t�F�j���A���j���̃��`���G�X�e���`�i75���̌��w���x�̂��̂ł���j�����w�I�ɏ����� Mosher ����ƌĂ��o��}���f���_�̗U���̂p�ƃg���G�`���A�~���̑��݉������������B
11-1�@�������`���o����тp�Ƃ��ꂼ�ꔽ�������ē����鉻�����̍\�����������Ȃ����B
11-2�@��L�̔����������Ȃ��ۂ̃g���G�`���A�~���̖����͉����B���̑I�������琳�������̂�I�тȂ����B
���@�G�X�e���`�̃��Z�~����h������
���@�������鉖�����f�𒆘a���邽��
���@�G�X�e���`�����������邽��
���@�ߏ�ɗp�����o�܂��͂p�ƍ��̂��`�����邽��
11-3�@���11-1�ō��������������i�U���́j�̂m�l�q�X�y�N�g���ɂ����Ď��̃v���g���i���f���q�j�̃V�O�i���ɑΉ�������̂��X�P�b�`���Ď����Ȃ����B�i�������`��75���̌��w���x�ł��邱�Ƃɒ��ӂ��邱�Ɓj
(a)�@�o�Ɣ������ē�����U���̂̃��g�L�V��ɑΉ�����v���g��
(b)�@Q�Ɣ������ē�����U���̂̃��g�L�V��ɑΉ�����v���g��
11-4�@�o�Ɣ������ē�����U���̂� 19F �m�l�q�̃V�O�i�����X�P�b�`���Ȃ����B
���12�@�@�|�����_
�|�����_�ipolylactic acid, PLA�j�͐����𐫃|���}�[�Ƃ��ďd�v�ł���BPLA�̓I�����_�ł͂��Ȃ��K�͂ɐ��Y����Ă���B���̍\���P�ʂ�(+)-���_�ł���C����͓��ނ̔��y�ɂ�蓾����BPLA�̖��͓I�Ȑ����͐����𐫂�����Ƃ������Ƃł���BPLA�͈�w�I�ȉ��p���삪����C���Ƃ��Ἀ��ɖ��ߍ��ލޗ���h���b�O�f���o���[�i���̓��ł������ƕ��o����悤�Ȃ����݁j�Ȃǂɗp�����Ă���B�����q�ʂ�PLA�́C���_�܂��́i���_���瓾����j��̃W���N�g��A���獇�������B
12-1 ���_����o������PLA�̂S�ʑ́m��Ғ��F���_�̂S�ʑ̂̂��Ƃ��w���Ă���n�鉻�w�������������B
12-2 ��W���N�g��A����o������PLA�̂S�ʑ́m��Ғ��F���_�̂S�ʑ̂̂��Ƃ��w���Ă���n�鉻�w�������������B
���_�̏d�����ɔ����ɂ��̐ϕω��͂Ȃ����̂Ƃ��C�܂��G�X�e�������̕��t�萔���S�ł���Ƃ���B�d�������̔�������p�Ƃ���ƁC�d���x�i�����q���P�{������Ɋ܂܂�郂�m�}�[�̕��q���̕��ϒl�j��P = 1/(1-p)�ƕ\�킳���BPLA�̍�����U [mol]�̓��_����J�n�������̂Ƃ���B
12-3 �����������n���琅����菜���Ȃ��Ƃ�����C�d���x�͍ő傢���ɂȂ邩���v�Z����B
12-4 10 [mol]�̓��_����o�����āC�d���x��100�ɂȂ�悤�ɂ���ɂ́C�ǂ�قǂ̐����n�O�ɏ����K�v�����邩���v�Z����B
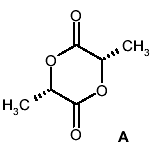
���13�@���w�̃p�Y��
�������`�͉��w���b�W�g�X�m�Q�n�Q�b���ŕ\�킳��A���ɕs�n�ʼn���ł���B�܂��������`�͔������_�ɂ������Ɨn���Ă����B
13-1 �������`�̂ǂ̌��q���g�b���Ɣ����Ɋւ���Ă��邩�H
�������`�͉����A�Z�`���Ə������������Ď_�ɂ�����ɂ��s�n�̉�����������B
13-2 �������`�̂ǂ̊��\������A�Z�`���Ƃ̔����Ɋ�^���Ă��邩
�������`�̂g�|�m�l�q�X�y�N�g���̃`���[�g�����Ɏ����B
13-3 �V�O�i�����Ƃ��͂ǂ̊�(group)�̑��݂������Ă��邩
�������`��Sn�^�g�b���Ɣ������I���Ɖ��w���b�W�g�P�P�m�Q�b�������������a����������B
13-4 �r���^�g�b���Ƃ̔����ɂ����Ăǂ̊��\��ւ���Ă��邩
13-5�@�^����ꂽ�������ɂ��Đ��肳��鉻�����`�̍\������`���B�i�q���g�F�������`�͏Ɏ_��̗n�t�Ƃ͂��Ƃ����M�����Ƃ��Ă��������Ȃ��j
���14 �f���t�g�Ă��̐ƃr�^�~��B12
�L���ȃf���t�g�Ă��̓���ɓ��L�̐F�́C����̂��킮����̔����w�̒��Ɋ܂܂�Ă���Co2+�C�I���̐ԐF���ƗΐF���̋z���ɂ����̂ł���B���̂��킮����́C�R�o���g�̉����K���X�����Ƃ��̐����C�Ⴆ�C�P�C�_����z�E�_���C�i�g���E���ȂǁC�ƍ����č����B�����āC���M�ɂ���āCCo2+�C�I�����܂ޔ����K���X�̑w���`�������B����Co2+�C�I���͕����I�ɖ������ꂽ3d�O�������J�ڋ����ł���B3d�J�ڋ����C�I���̐F�́C���̌�����ɂ���ĕ��ꂽ��G�l���M�[3d�O���ƍ��G�l���M�[3d�O���Ԃ̓d�q�̑J�ڂɂ���Đ�����B
14-1 Co2+�̊��S�ȓd�q�z�u�������Ȃ����i�R�o���g�̌��q�ԍ���27�j
14-2 �T��3d�O���̌`��`���Ȃ����Bx-, y-,z-�����������ƁB
3d�O���̊Ԃł̑J�ڂ͂���قNj����Ȃ��B�ΐF�ƐԐF�ł�Co2+�̃����z���W���́C20 M-1 cm-1�ł���B�N�₩�ȐF�Ƃ��邽�߂ɂ͖�90%�̐ԐF���ƗΐF�����z�������K�v������B
14-3 ���킮����̑w�̌������P mm�Ƃ��āC���킮���蒆��Co2+�̔Z�x���v�Z���Ȃ����i�q���g�FLambert-Beer�����g���j�B
�̓��ɂ����ʂ�Co�C�I�������݂��Ă���C���̑啔���̓r�^�~��B12�̒��Ɋ܂܂�Ă���B�̏d70 kg�̐l�̑̓���Co�̑��ʂ͖�3 mg�ł���B1964�N�ɁCDorothy Crowfool-Hodgkin�́C���̃r�^�~���̍\�����𖾂������тɂ��m�[�x���܂����^���ꂽ�B���̍\�������Ɏ����Ă���BCo�͂��܂��܂Ȏ_����Ԃ��Ƃ邱�Ƃ��ł���B�ʏ�̎_����Ԃ�2+��3+�ł��邪�C�r�^�~���a12�ł́CCo+���\�ł���B
�r�^�~��B12 �i�q�̓A�f�m�V�����j
14-4 �R�̈قȂ�_����Ԃɑ��āC�C�I�����a���傫���Ȃ鏇�Ԃ�Co�C�I������ׂȂ����B
14-5 Co�C�I���i1+, 2+, 3+�j�̂ǂ̎_����Ԃɂ����āCEPR�i�d�q�펥�����j�X�y�N�g���̃V�O�i�����ϑ��ł��邩�B�S�Ă̎_����Ԃɂ����鍂�X�s���z�u�𐄑�����B
14-6 �̏d70 kg�̐l�̑̓��ɂ͂�����Co�C�I�������݂��邩�v�Z���Ȃ����iCo�̌��q�ʁ�58.93�j�B
14-7 �r�^�~��B12���̒��̃R�o���g�̔z�ʐ��͂������i���������Ɉ�����Ȃ����j�B
�V�������i�̊J���͗L�@�����Ɉˑ�����Ƃ��낪�傫���B�]�݂̐����邽�߂ɁC���q�\���̔������������ΕK�v�ƂȂ�B�����ł́C��a�̎��ÂɎg����Ǐ������܃v���p���J�C���i�ʖ��v���L�V���^�J�C���j�ɂ��čl����B
15-1 A, B, C, D �����E�̍\����`�������X�L�[�������������Ȃ����B
�S�Ă̐������͂�����ƒP���������̂Ƃ���B
15-2 ���^−�q�h���L�V�������_���o�������Ƃ����ꍇ�C�ǂ̈ʒu���j�g�������ꂽ�������������邩�H���i���j�̍\����`���Ȃ����B
15-3 ��Q�i�K�̔����ɂ����āCn-C3H7Cl�̑����tert-C4H9Cl���g���ƁC���̂����̂ǂ̂悤�Ȍ��ʂɂȂ邩�B
�� B�Ɠ��l�ȍ\��������������������
�� �S���������Ȃ�
�� tert-C4H9Cl����������
�� �F�����u���������N����
���������Ɉ�����Ȃ����B
��� 16 �y�v�`�h�̍\��
�^���p�N���͑S�Ă̐����̍זE���ɑ��݂��C�����̉��w���ۂɂ����鑽���̋@�\���ʂ����Ă���B�^���p�N���̓�-�A�~�m�J���{���_����\������Ă���B�y�v�`�h�͔�r�I�����̃A�~�m�_����Ȃ�e�������f�^���p�N���ł���B�y�v�`�h�����̓A�~�h�����̈��ň�̃A�~�m�_�̃A�~�m��Ɨׂɗ���A�~�m�_�̃J���{�L�V����Ƃ̍�p�ɂ��`���������̂ł���B
16-1 �t�F�j���A���j�� F�ƃA���j�� A ���瓾����W�y�v�`�h�͂ǂꂩ�H
�y�v�`�h�̍\���̕��͂ɂ�����N-���[�����C-���[�̎c��͏d�v�Ȗ���������BN-���[�c��(�y�v�`�h���ŗV���̃A�~�m���L����A�~�m�_�P�ʂ̂���)�����肷��Sanger�̕��@�́C���₩�ȃA���J������������
2,4-�W�j�g���t���I���x���[���ɂ���ď������C���̌�S�Ẵy�v�`�h�������_������������ߒ����܂�ł���BN-���[�A�~�m�_�͉��F�̕W���f�Ђ�L���C����̓y�[�p�[�N���}�g�O���t�B�[���͂ŗe�ՂɌ��o�ł���BSanger��1958�N��1980�N�Ƀm�[�x���܂��Ă���B
16-2 Sanger�̎���̏����ł͂ǂ̂悤�Ȕ������N���Ă��邩(�P�����̂��߃y�v�`�h��N-���[���̃A�~�m�_��H2NR�ƕ`���Ȃ���).�������Ŏ����Ȃ����B
�y�v�`�h�̒��ŗV����CO2H ������C-���[�c��̓����,�J���{�L�V�y�v�`�_�[�[(�X�����瓾����y�f)�ɂ��I��I��C-���[�P�ʂ̉��������ɂ���ĒB�������B�A�~�m�_F, A, ����уO���V�� G
�����ă��C�V�� L ����Ȃ邠��e�g���y�v�`�h��C-���[�c���F�ł��邱�Ƃ����������BSanger�̕��@�ɂ��
N-���[�P�ʂ�G�ł��邱�Ƃ������ꂽ�B
16-3 ���̃y�v�`�h�ɉ\�ȍ\���𐄒肵�Ȃ����B�\���������Ȃ����B
���P�V�@���{�k�N���A�[�[
�E�V���������{�k�N���A�[�[�`�͂q�m�`������y�f�ł�����Ɉ���ł���B���g�V�̐�����100 �� �ɉ��M���Ă����̊����͎����Ȃ��B���̂悤�Ȑ����́C���̑啔���̍y�f�l�ɏ�������Ǝ������܂����ƂƂ͑ΏƓI�ł���B���{�k�N���A�[�[�`�����̂悤�Ɉ���ł��闝�R�́C���q����8�̃V�X�e�C���c��̊ԂłS�̂r�|�r�ˋ����`�����邱�Ƃɂ������3�����\�����ێ��ł��邽�߂ł���B�r�|�r�ˋ��\���́C�����Ɏ����悤�ɁC�V�X�e�C���c��ɑ��݂���`�I�[����̎_������ (oxidation) �ɂ��`�������B
17-1�@2�|�����J�v�g�G�^�m�[���̂悤�ȊҌ��܂͂r�|�r������ؒf���邱�Ƃ��ł���B�ʂ�2�|�����J�v�g�G�^�m�[����p���Ăr�|�r������ؒf���鎟�̔����������������邽�߁C�`�C�a�C�b�̍\�����������Ȃ����B
17-2�@����ς����̎O�����\�������邱�Ƃ��m���Ă���v�f�͎��̂����ǂꂩ�B
���@�v�������𑽂��܂ނ���
���@��C��
���@�Ód��
���@�d��
���@���f����
���@����
���@�����̃T�C�Y�i��^�̓����͂�����Ȃ���ς��������j
���@�t�@���f�����[���X��
�������}�[�N���Ȃ����B�����͕������݂���\���������B
��� 18�@�@�y�f�����̓��͊w
�y�f��p���锽���͉��w�ɂ����ďd�v�ł���D�����̔����̓��͊w�I�ȉ�͓͂T�^�I�ȍy�f�̐U�镑���𗝉�����̂ɖ𗧂DE���y�f�Ƃ��Ċ A�� B����������Ƃ��C������
(1) �` (5)�̎��ŕ\�����D
�@�@(1) E + A ���� EA
���t�萔 KA
(2) E + B ���� EB
���t�萔 KB
(3) EB + A ���� EAB
���t�萔 K�fA
(4) EA + B ���� EAB
���t�萔 K�fB
(5) EAB �� products
�������x v = k [EAB]
�������x���������Ƃ��ɂ́C���� (5)�̂��߂� (1) �` (4)�̕��t�͂قƂ�Ljړ����Ȃ��D���̂��Ƃ�� (6)�̎����������DVmax�͍ő唽�����x�ŁC�y�f����ɂ��O�a����Ă���Ƃ��C���Ȃ킿�S�Ă̍y�f�� A�� B������������Ԃ̂Ƃ��̔������x�ł���D
(6)
![]()
18-1 �@�@KA,
KB, K�fA, K�fB�����ꂼ��̔Z�x�̋L���ŕ\���D
�}���g�[�X(maltose)���C�[�X�g�̍y�f ��-�O���R�V�_�[�[(��-glucosidase)�ɂ������������l���Ă݂�D
(7) �}���g�[�X + H2O
�� 2 �O���R�[�X
�ʏ�͊�̃}���g�[�X�̔Z�x�͈͂́C10-4���� 10-1 M�ł���C���͗n�}�ł���̂Ő��̔Z�x�͎��� 55.6 M�ƍl���Ă悢�D�����ŁC(6)�� [B]����ɋ߂Â��ĊȒP�ɂ��邱�Ƃ��ł���D
18-2 �@�@�� (6)���ȒP�ɂ������̂������D���̕\���̓~�n�G���X – �����e��(Michaelis-Menten)�̎��Ƃ��ėL���ŁC����P�̏ꍇ�ɐ��藧�D
18-3 �@�@(a) [A]���������C���Ȃ킿 0�ɂ��邱�Ƃɂ��Michaelis-Menten�̎�������ɊȒP�ɂ���D
(b) �������� n�́Cv = kcn�Œ�`�����D[A] �� 0�̂Ƃ��C���������͂������D
18-4�@�@(a) [A]����ɑ傫���C���Ȃ킿 ���ɂ��邱�Ƃɂ��Michaelis-Menten�̎����ȒP�ɂ���D����͊�ɂ��y�f���O�a���Ă���ꍇ�ł���D
(b) [A] �� ���̂Ƃ��C���������͂������D
18-5�@�@�萔 KA�͍y�f�̊�ւ̐e�a���̎ړx�ł���D�����e�a����L����ꍇ�ɂ́CKA�͑傫�Ȑ��l�ƂȂ邩�C����Ƃ��������Ȃ邩�D���x v�������̂Ƃ� [A]
= KA�ƂȂ邩�D
18-6�@�@���x v�� [A]�i�����j�̃O���t�������DVmax�� KA���O���t��Ɏ����D
�y�f�����͑j�Q�� I�����݂���Ǝ��̎��Ɏ������悤�ɁC�����͋����}�������D
(8)
E + I ���� EI�@�@���t�萔 KI
�����I�ȑj�Q�̏ꍇ�C�j�Q�ނ͍y�f�̌������鑤�Ɉʒu����D���̂Ƃ���Ƌ����ɂȂ�D����ŁC�����͒x���Ȃ�D�������CVmax�ɂ͉e�����Ȃ��D�����āCMichaelis-Menten�̎��ɂ����� KA�� (1 + [I]/KI)�{�����D������ (1 + [I]/KI)�� [I] = 0�Ȃ� 1�C[I]���傫����Α傫�Ȓl�ɂȂ�D���I�ȑj�Q�̏ꍇ�́CI�� A�͋��������CKA�͉e������Ȃ��DVmax�͏������Ȃ�D�����āCMichaelis-Menten�̎��� Vmax�� (1 + [I]/KI)�Ŋ����Ă���D��-�O���R�V�_�[�[�ɂ���������������ɒ��ׂ邽�߂ɁC�}���g�[�X�̑���Ɋ���f���Ƃ��ăp���j�g���t�F�j��-��-D-�O���R�V�h(p-nitrophenyl- ��-D-glucoside �GPNPG�Ɨ���)���p������D�����p����Ɖ��F�̃p���j�g���t�F�m�[���̕��o���C���z���X�y�N�g���̑���ɂ��ǐՂ��邱�Ƃ��ł���D����C�}���g�[�X�̑��݂���Ƃ���ŃO���R�V�_�[�[�̊����ׂ邽�߂�PNPG��p�����������s�����D
18-7�@�@�ǂ̂悤�ȏ����ōs��ꂽ���D
�@�@�@�@���@�p���j�g���t�F�m�[���̕��o���x�Ƀ}���g�[�X���e�����Ȃ������D
���@�}���g�[�X�������I�ȑj�Q�ނɂȂ�����D
���@�}���g�[�X�����I�ȑj�Q�ނɂȂ�����D
�����Ɉ��t����D
18-8 �}���g�[�X�� [�}���g�[�X] = K�}���g�[�X�ƂȂ�悤�ɑ��݂������Ƃ��C�p���j�g���t�F�m�[���̕��o�ɂ�����V�� [A]�i�����j�̃O���t�������D��18-6�̃O���t�ɏ���������DVmax�� 1/2 Vmax�̓_�Ɉ��t����D
�@
���P�X�@����̋��啪�q
�@
�@�f���h���}�[�͒������}�����ꂵ�����̂悤�ȍ\�����Ƃ鋐�啪�q�ł���B�����̉�������������@�̈�̓}�C�P���t�������̗��p�ł���A���̊ȒP�ȗ���ȉ��Ɏ����B
�f���h���}�[�͎��̏��Ԃ̔����œ��邱�Ƃ��o����B
(1) NH3���ߏ�̃A�N�����j�g����(H2C=CH-C��N)�œO��I�ɏ������邱�Ƃɂ��A3�̃V�A�m����܂ސ�������B
(2) ���̐�������H2�ƐG�}�ŊҌ����A3�̑�ꋉ�A�~�m����܂�1���q��B
(3) ���̑�ꋉ�A�~�����Ăщߏ�̃A�N�����j�g�����ŏ�������B
(4) ��L�̃X�e�b�v(3)�̐��������Ă�H2�ƐG�}�Ő��f�����A6�̃A�~�m���1���q���Ɋ܂ރw�L�T�A�~����B���ꂪ�}�����ꂵ�����啪�q�̐����̎n�܂�ƂȂ�B
19-1 (��) �X�e�b�v(1)�̔����������߂��B
(��) �X�e�b�v(2)�̔����������߂��B
(��) �X�e�b�v(3)�̐������̍\�����L���B
(��) �X�e�b�v(4)�̐��f�����ꂽ�������̍\�����L���B
�@�A�N�����j�g���������Ƃ���ɑ����V�A�m��̊Ҍ��𐔉�J��Ԃ��ƁA�\�ʂɑ�ꋉ�A�~�m���������̕��q��������B
19-2 ���̊Ҍ��T�C�N����5��i�������A��1��ڂ̃T�C�N���̓X�e�b�v1+2�Ƃ���j�J��Ԃ��Đ��������f���h���}�[�̖��[���ɑ�ꋉ�A�~�m���܂܂�Ă��邩�A�v�Z�����B
19-3 (��) NH3 1�����ɑ���5��̊Ҍ��T�C�N���ŕK�v�ƂȂ鐅�f�̗ʂ��������Ƃ������߂��B
(��) 5��̊Ҍ��T�C�N���ŕK�v�ȃA�N�����j�g�����͉����������߂��B
(��) 1��̊Ҍ��T�C�N���ɂ��A���̃f���h���}�[�̒��a�͖�10A��������B5�T�C�N���Ҍ����ꂽ�f���h���}�[���q�̑̐ς��Z�o�����B
l-�J���{���̓X�y�A�~���g��n�b�J���Ɋ܂܂�鉻�����ł���C�}�C�i�X�̔�����x�������D����C�����ِ��̂�d-�J���{���̓J���E�F�C���Ɋ܂܂�Ă���C�v���X�̔�����x�����D�J���{�������w���͂���ƁC�Y�f80.00���C���f9.33���C�_�f10.67������ł��Ă���C���ʕ��͂�肻�̕��q�ʂ�150�ł������D�J���{���̃v���g���j���C���z���X�y�N�g������ѐԊO�z���X�y�N�g���͈ȉ��̐}�Ɏ����D�܂��C���O�z���X�y�N�g����238nm�ɋ����z���������D
20-1
�J���{���̕��q�������߂�D
20-2
�J���{���̂��s�O�a�x�����߂�D
20-3
�ԊO�z���X�y�N�g���}�ŁC1680cm-1�̋����z���́C�J���{�����q�̂ǂ̊��\��ɂ����̂��D
20-4
�J���{���́C3200cm-1���傫�ȗ̈�ɂ͋����z�����Ȃ����������D�J���{���ɂ͂ǂ̂悤�Ȋ��\������ƍl�����邩�D
200
MHz�̃v���g���j���C���z���X�y�N�g���ׂ�ƁC���̗l�ȋz���т��ϑ����ꂽ�i�����ł͉��u�X�s�������͍l���Ȃ����̂Ƃ���j�D
|
d (ppm) |
�z���X�y�N�g���̎�� |
�ϕ����x |
|
1.63 |
��d�� |
3 |
|
1.68 |
��d�� |
3 |
|
1.9-2.2 |
���d�� |
2 |
|
2.2-2.5 |
�d�Ȃ������d�� |
3 |
|
4.75 |
��d�� |
1 |
|
4.93 |
��d�� |
1 |
|
6.73 |
�O�d�� |
1 |
20-5�@�J���{�����U���Y�f���i�\���������C����������1,2,4-�ʂ��u�����ꂽ���q�\�������Ɖ��肷��Ȃ�C�œK�ȕ��q�\���͉����D
�J���{����1H NMR �X�y�N�g���i�J�b�R����4.5-5.0 ppm
�̗̈�̊g��}�j
�J���{���̂h�q�X�y�N�g��
��Q�P�@�d�C���w�I�G�l���M�[�ϊ�
�����̉�X�̎Љ�ł́C�l��ו��̈ړ����₷���͋ɂ߂ďd�v�ł���D�d�C�����Ԃ͏����ɂ����鎄�����̈ړ���i�ɕK�v�Ȃ��̂Ƃ��āC����Ɍ����J�����i�߂��Ă���D�d�C�ɂ��쓮������蕨�ɂ�����傫�Ȗ��̂ЂƂ́C�K�ȓd���̋����Ƃ����_�ł���D�d�r��p����ꍇ�C�i�d���������܂ōs���āj�ď[�d���Ȃ���Ȃ�Ȃ����߁C�s�����a�������Ă��܂��D����C�R���d�r�̏ꍇ�́i�Ԃɓ��ڂ��ꂽ�j�d�r���̂Ŕ��d���s���邱�Ƃ���C�i�d�C�����Ԃ̓d���Ƃ��āj�d�r�ɑ��閣�͓I�ȑI�����Ƃ�����D�R���d�r�́C��������A���I�ɋ������Ȃ���p����^�C�v�̉��w�d�r�ł���D�R���d�r�́C�d�C�ݏo�����߂ɔR�Ĕ����𗘗p���Ă���D�i���ɁC���Ɂj�e�X�̓d�ɂɂ����Ĕ������̔��d�r�������N����C����ɂ�萶�����d�q���O����H��ʂ��ė����D���d�ɂ̓C�I���`�����̓d���t�������́C�n�Z���C�ő̓d�����ɂ��u�Ă��Ă���D���_���J���E���Z���n�t��d�����ɗp���鐅�f�]�_�f�^�R���d�r�̓d�ɂɂ����锼�d�r�����́C���̂悤�ɕ\�����D
O2(g) + 2H2O + 4e- �� 4OH-(aq) (1)
H2(g) + 2OH-(aq) �� 2H2O + 2e- (2)
�d�q�̐����Ə�����ʐ������ۂ̔R���d�r�����i�S�����j�́C���̂悤�ɕ\����D
2H2(g) + O2(g) �� 2H2O (3)
�����������́C�i�Ȃ�Ɓj���I�ł���C�����͂��悻50�`60���ł���D
21-1�@�ǂ���̔��������ɑ��ŋN���邩�H
21-2�@�ǂ���̔��������ɑ��ŋN���邩�H
21-3�@�d�����������_�̏ꍇ�̓d�ɔ����������D
�M�u�Y�G�l���M�[�ω���G0�͔����̋쓮�͂𑪂镨�����ł���D�����ŁC�G�l���M�[�ω��͎��̎��ŕ\����D
��G0 = -nFE
�����ŁCn�͔����ɂ�藬���d�q���CF�̓t�@���f�[�萔�i96487C�j�ł���DO2(g)��25���ɂ�����W���d�ɓd�ʂ�+1.23V�ł���D
21-4�@�_���������ɂ�����R���d�r�����́�G0���v�Z����i21-3�Q�Ɓj�D
�R����R�₷���Ƃɂ�藘�p�\�ȃG�l���M�[�����o���̂́C�ɂ߂Č����̈��������ł���D�I�����_�ł́C�L�x�ɑ��݂���V�R�K�X�͖��͓I�Ȏ����ł��邪�C���݂̉Η͔��d�v�����g�ł́C�V�R�K�X���痝�_�I�Ɏ��o����G�l���M�[�̂����킸��35�`40���������Ă��Ȃ��D�V�R�K�X(���^���j�̎_�f�������ɂ����锽���i���M�����j�͎��̂悤�ɕ\����D
CH4(g) + 2O2(g) �� CO2(g) + 2H2O(g) + �G�l���M�[
�ʏ�C���̔������瓾��ꂽ�G�l���M�[�́C�g�[��@�B���͂Ƃ��ĊԐړI�ɗ��p����Ă���D�������C�C�I���`�����ő̎_������p���鍂���^�Z���~�b�N�X�R���d�r�ɂ����ẮC�V�R�K�X�͐G�}�Ȃ��Œ��ڔR���Ƃ��Ďg�p�\�ł���C���̌�����75%���x�Ƌɂ߂č����D���̏ꍇ�̔R���d�r�̑S�����́C���̂悤�ɕ\����D
CH4(g) + 2O2(g) �� CO2(g) + 2H2O(g)
21-5�@���ɑ�����ѐ��ɑ��ɂ����锽�������ꂼ�ꎦ���D
�����^�R���d�r�Ƃ��āC���̑��ɗn�Z�Y�_�����C�I���`�����d�����Ƃ��ėp������̂�����D���̏ꍇ�C���f���R���Ƃ��ėp�����C�܂��_�f�͓�_���Y�f�ƍ���������Ԃŗp������D
21-6�@���ɑ�����ѐ��ɑ��ɂ�����e�X�̔��d�r�����C����єR���d�r�Ƃ��Ă̑S�����������D
���22�@�~�Z��
���̖��͐����זE���ő����̏d�v�Ȗ������ʂ����Ă���B�A���⓮���̍זE�̖���40-50%�̎�����50-60%�̃^���p�N�����܂�ł���B���̖��̏d�v�ȍ\�������ł��郊�������͑a���I�Ȏ��b�_�����ƕ��ɂ��Đe���I�ȓ�������Ȃ��Ă���B���̂悤�ȍ\���͈�ʂɗ��e�}�����܂Ƃ����B���Ɋւ���m���͗��e�}�����܂̂��P���ȍ\���̕��q�����ÏW�����̌����ɂ���ē�����B�T�^�I�ȋÏW�̂̓~�Z���ł���C����͒P���q�܂��͓q�\���Ńx�V�N���܂��͏����(���|�\�[��)�Ƃ���Bn-�h�f�V�����_�i�g���E��(SDS)��L��n-�h�f�V���g�����`���A�����j�E��(DTAB)�Ȃǂ̔�������̊C�ʊ����̕��q�́C�ՊE�~�Z���Z�x(CMC)�ȏ�̔Z�x�ɂȂ�Ɛ��֗n�����Ă����Ԃ���~�Z���������I�Ɍ`������B�~�Z���̍\����}�Ɏ����B�����̃~�Z���ɂ����āC�����̑a���I�Ȋj���������ʂł��C�����̊��\��Ƃ��̑C�I�����܂ޑw(Stern layer)�Ɛ��a�����C�I�������O���̊k(Guoy-Chapman layer)�����ʂł���BSDS�̃~�Z���ł͒����̊j�͔��a16.6�I���O�X�g���[����Stern layer��4.6�I���O�X�g���[���̌����������Ă���B
�\
|
���e�}������ |
�@�ՊE�~�Z���Z�x(CMC)�@ |
�@���~�Z������ |
|
|
�@(mmol L-1)�@ |
�@(g mol-1 �~ 103) |
|
SDS |
8.1 |
18.0 |
|
DTAB |
14.4 |
15.0 |
22-1�@����SDS�̃~�Z����Stern layer�̑̐ς��v�Z���Ȃ����B
��̒P�����������f���ɂ����āC�~�Z���̌`�������̕��t���ɂ���ĕ\�����邱�Ƃ��ł���F
�@<���t��>�@n S + n B �E(���t���) M
������S�͗��e�}�����܂��CB�͑C�I�����C������n�͊܂܂�镪�q�̐��������BS�ɂ��Ẵ~�Z���`���̕W��Gibbs�G�l���M�[�͉��̎��ɂ���Ď������F
�@
![]()
�@
������KM�͕��t�萔�B�ՊE�~�Z���Z�x�ɂ�����[M] = 0 �ł���B�܂��C[S]��[B]�ɂقړ������Ɖ��肵�Ȃ����BR�͋C�̒萔�ł���(8.314
J mol-1 K-1)�B
22-2�@SDS�̃~�Z���`���̃�GM��DTAB�̃~�Z���`���̃�GM���v�Z���Ȃ����B
22-3�@SDS��DTAB�̃~�Z���̗��e�}�����ܕ��q�̐����v�Z���Ȃ����B